在化学实验中,制取二氧化碳是常见的实验操作之一。选择合适的装置是成功制取二氧化碳的关键。本文将从个人角度出发,详细介绍常见的制取二氧化碳装置,并结合装置图进行解析。
一、 制取二氧化碳反应原理
实验室制取二氧化碳通常利用碳酸盐与酸反应的原理。以常见的碳酸钙 (CaCO3) 与稀盐酸 (HCl) 反应为例,反应方程式如下:
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
反应生成二氧化碳气体,同时生成氯化钙和水。二氧化碳密度大于空气,且不溶于水,因此可通过向上排空气法收集。
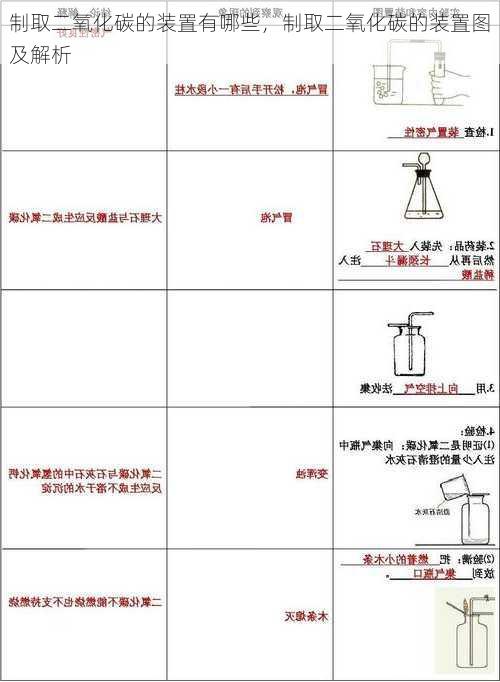
二、 制取二氧化碳的装置
制取二氧化碳的装置主要由发生装置和收集装置组成。常用的发生装置主要有以下几种:
1. 简易装置
简易装置通常采用锥形瓶作为反应容器,并通过长颈漏斗添加稀盐酸。锥形瓶的口部连接导气管,将产生的二氧化碳气体导入收集装置。
| 装置组成 | 描述 |
|---|---|
| 锥形瓶 | 反应容器,用于盛放碳酸钙和稀盐酸 |
| 长颈漏斗 | 用于添加稀盐酸,并能控制反应速率 |
| 导气管 | 连接锥形瓶和收集装置,用于引导二氧化碳气体 |
| 集气瓶 | 用于收集二氧化碳气体 |
| 烧杯 | 用于盛放水,用于检验二氧化碳气体是否收集满 |
| 橡皮塞 | 用于密封装置,防止气体泄漏 |
| 滴管 | 用于向反应容器中滴加少量液体,如稀盐酸 |
| 药匙 | 用于取用固体,如碳酸钙 |
2. 改进装置
改进装置是在简易装置的基础上,对装置进行优化改进。主要改进之处在于加入了控制反应速率的装置,例如分液漏斗。使用分液漏斗可以更加精确地控制稀盐酸的添加量,从而更好地控制反应速率。
| 装置组成 | 描述 |
|---|---|
| 锥形瓶 | 反应容器,用于盛放碳酸钙 |
| 分液漏斗 | 用于添加稀盐酸,并能精确控制反应速率 |
| 导气管 | 连接锥形瓶和收集装置,用于引导二氧化碳气体 |
| 集气瓶 | 用于收集二氧化碳气体 |
| 烧杯 | 用于盛放水,用于检验二氧化碳气体是否收集满 |
| 橡皮塞 | 用于密封装置,防止气体泄漏 |
| 滴管 | 用于向反应容器中滴加少量液体,如稀盐酸 |
| 药匙 | 用于取用固体,如碳酸钙 |
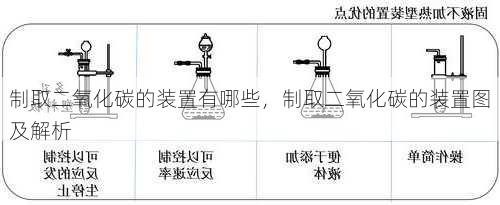
三、 制取二氧化碳装置图及解析
以下是两种常用制取二氧化碳装置的示意图:
1. 简易装置图

解析:
锥形瓶中盛放块状的碳酸钙,长颈漏斗中加入稀盐酸,并通过漏斗颈部的玻璃管将稀盐酸滴入锥形瓶。
反应生成的二氧化碳气体通过导气管进入集气瓶中。
利用排水法收集二氧化碳气体,当集气瓶中的水全部排出时,说明二氧化碳气体已经收集满。
2. 改进装置图

解析:
锥形瓶中盛放块状的碳酸钙,分液漏斗中加入稀盐酸。
通过打开分液漏斗的活塞,控制稀盐酸的滴加速度,从而控制反应速率。
反应生成的二氧化碳气体通过导气管进入集气瓶中。
利用向上排空气法收集二氧化碳气体,当集气瓶中燃着的木条熄灭时,说明二氧化碳气体已经收集满。
四、 选择制取装置的原则
选择制取二氧化碳装置的原则主要包括以下几点:
反应物的状态: 固体与液体反应,可以选择简易装置或改进装置;
反应速率: 反应速率较快,可以选择改进装置,以更好地控制反应速率;
气体的性质: 二氧化碳密度大于空气,且不溶于水,可以选择向上排空气法收集。
五、 制取二氧化碳的注意事项
制取二氧化碳过程中,需要特别注意以下几点:
检查装置的气密性: 在开始实验之前,必须先检查装置的气密性,确保装置能够有效地收集二氧化碳气体。
控制反应速率: 反应速率过快会导致气体收集效率降低,反应速率过慢会导致实验时间过长。
安全操作: 稀盐酸具有腐蚀性,操作时要小心谨慎,避免接触皮肤和眼睛。
六、 制取二氧化碳的应用
制取二氧化碳在化学实验中有着广泛的应用,例如:
检验二氧化碳的性质;
制取碳酸饮料;
制取碳酸氢钠;
作为气体灭火剂等。
七、 总结
制取二氧化碳是常见的化学实验操作,选择合适的装置是实验成功的关键。本文详细介绍了常见的制取二氧化碳装置,并结合装置图进行了解析,希望能够帮助大家更好地理解和掌握制取二氧化碳的实验操作。
思考:
除了文中提到的装置,你是否还知道其他制取二氧化碳的装置?你认为哪种装置更适合制取二氧化碳?请在评论区分享你的想法。
